- 近期网站停站换新具体说明
- 按以上说明时间,延期一周至网站时间26-27左右。具体实施前两天会在此提前通知具体实施时间
主题:大家对【原研药】怎么看 -- 斯特拉斯堡
仿制药是要购买专利授权对吧,公司行为,跟政府有啥关系?
不用担心老审的心脏,他有古法炙甘草汤,效果比正经中医的都好。
真正值得观察的是这事下一步怎么走。这事的几方都挺有意思的。
有人是想彻底推翻集采的。这个不论。
国内的粉红恨不得说“麻药不麻、泻药不泻”根本不存在。他们传出来的消息是,一线医生拿不出统计证据,领头的先生只好把微博删了。废话,要我是一线医生,我也拿不出证据。我第一不会有心搜集数据形成正式的证据,第二我就是有证据,也不敢这么大张旗鼓地拿出去。
现在医保局发文,说集采协议量一般在医疗机构报量的60%-80%,剩下的是你们自主采购的,没说不许你买进口原研药。于是据说上海的医院又能开到进口原研药了。
但我觉得这也很扯,纯属甩锅。药品是有保质期的,你把60%-80%的量买了,那下面能不用吗?当然是层层下压优先用,为了让你用干脆不许你用进口原研药。这种层层加码,成年人都知道。
所以,我认为,这次医保局看起来雷厉风行,但其实反映了体制内正常讨论的空间已经很小了,大家都疲于甩锅避责。这不是什么好事情。
这和降压药一天吃一片或一天吃二片一样,看病情和剂量罢了。
偏偏都怪到集采头上了,看来集采动了太多医生的蛋糕了。
但我觉得这也很扯,纯属甩锅。药品是有保质期的,你把60%-80%的量买了,那下面能不用吗?当然是层层下压优先用,为了让你用干脆不许你用进口原研药。这种层层加码,成年人都知道。
你不会以为医院进药是一次性买满一年的药,所以要抓紧用,否则就过期了?
你觉得哪个医院会跟你想的这样蠢?人家都是分批进药的。
一般药品的有效期至少两年,这个你不会也不懂吧?就是一次性买满一年的药,也涉及不到什么有效期的问题。
脑补也别脑补出这么搞笑的出来
正借机反扑呢
面对如此情况医生很无奈,因为没有选择权,向上反映也没渠道。
瑞金医院普外科主任的“上面”应该是院长、交大校长、上海市卫健委、上海医保局吧。
真正管事的应该是上海医保局。但政策执行细节方面上海也管不了。
医生用药要顾及药占比、集采率、医保目录……这些都还是略可选择的,最难的是系统卡死——现在都是电子医嘱。
最后通过政协提案、媒体曝光的方式“沟通”,确实不好。
馈也是必不可少的,毕竟人体内系统还是很复杂的,仅靠体外检验是不够的。
或许可以向给篮球比赛打分一样,搞一个药品使用反馈的“药界虎扑”APP,让用户吃完药后去打分评价。
不过,这需要用户绑定病例数据,以防被人刷分。那这样又会带来信息保密的问题。保密性太好,APP要绑定用户的病例就更难;绑定数据容易,保密性就变差。可能有一个矛盾在里面,或许有专业的人可以解决这类的问题吧。
这可能得归功于你食安办老哥的道听途说。(奈何你信口开河不停,每贴必有新谎言出品)
你食安办老哥的道听途说:
一致性评价包括三个等效性:药学等效性、生物等效性、疗效等效性。
药物一致性评价中的“一致”主要分为两个方面:一、药学等效性;二、生物等效性。
你个大明白画蛇添足,加了个疗效等效性,弄巧成拙,再次为露脸结果把屁股露出来了。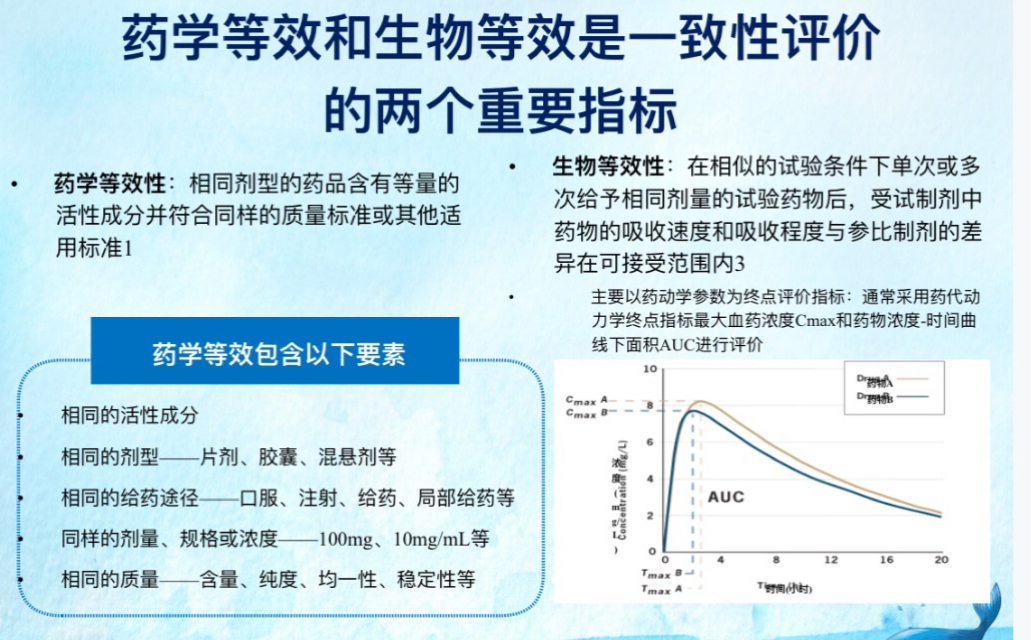
不写剂量,把用户吃坏怎么办,这种专利真的合格吗?应该是不合格的。
你吵了一天的成果:
1,中国的一致性评价标准,据说是抄美国的。
2,这个标准挺低的。据说是画一下仿制药和原研药浓度随时间变化曲线,如果曲线下面积和峰值浓度两个指标,仿制药都在原研药的[0.8,1.25]区间内,仿制药就过了。我当时就问,我拿原研药的85%做成片剂,当成仿制药去测,是不是能过?好像是能过。
你既然说中国是抄美国的。那就让美国FDA跟你说道一下:
Dispelling the 80-125% Myth
• Myth: Misconception that a generic can contain between 80% and 125% of the active ingredient that is present in the brand-name. This is false!
• Fact: The “80% to 125%” criteria is part of a statistical tool when measuring drug concentration in the blood and drug exposure over time. It does not pertain to a range of allowable active ingredient in the generic.
• Bioequivalence is determined by pharmacokinetic (PK) parameters
– Ideal PK ratio of the generic drug to the reference drug is 1:1, or 1.00 (indicating perfect bioequivalence)
– Every time a human takes a drug product (either the brand or generic) the PK measurement varies a little bit
– FDA uses a statistical tool to account for this variability (the 90% confidence interval of the PK ratio should lie between 0.80 and 1.25)
发现不同的作用也得重做双盲实验啊。
真的新药要好多步骤。
设计,化学性质/稳定性测试,细胞级别测试,动物实验,人体试验。。。一般花10 年以上。
发现确定“副作用”怎么也得至少重做动物实验,人体试验。。。
新药专利保护应该,鼓励研发。
问题是制药公司稍作无关痛痒的小改,重新申请专利,那就是暴利了。。。应该要求专利改动比例有个阈值,太小了就不批。。。准。。。。